海创药业股份有限公司(以下简称“海创药业”、“发行人”或“公司”)首次公开发行人民币普通股(A股)并在科创板上市(以下简称“本次发行”)的申请已经上海证券交易所科创板股票上市委员会审议通过,并已经中国证监会同意注册(证监许可〔2022〕250号)。发行人股票简称为“海创药业”,扩位简称为“海创药业”,股票代码为“688302”,该代码同时用于本次发行的初步询价及网下申购,本次发行网上申购代码为“787302”。
中信证券股份有限公司(以下简称“中信证券”或“保荐机构(主承销商)”)担任本次发行的保荐机构(主承销商)。发行人和保荐机构(主承销商)根据初步询价结果,综合评估公司合理投资价值、可比公司二级市场估值水平等方面,充分考虑网下投资者有效申购倍数、市场情况、募集资金需求及承销风险等因素,协商确定此次发行价格为42.92元/股。
招股书提示特别风险如下:
一、公司是一家采用第五套上市标准的生物医药行业公司
海创药业是一家基于氘代技术和 PROTAC 靶向蛋白降解等技术平台,以开 发具有重大临床需求的 Best-in-class(同类最佳)、First-in-class(国际首创)药 物为目标的国际化创新药企业。公司适用并符合《上海证券交易所科创板股票发 行上市审核规则》第二十二条第二款第(五)项规定的上市标准:“预计市值不 低于人民币 40 亿元,主要业务或产品需经国家有关部门批准,市场空间大,目 前已取得阶段性成果。医药行业企业需至少有一项核心产品获准开展二期临床试 验,其他符合科创板定位的企业需具备明显的技术优势并满足相应条件。”作为一家拟采用第五套上市标准的创新药研发公司,本公司提示投资者关注公司以下特点及风险:
(一)公司核心产品仍处于临床阶段,公司尚未盈利并预期持续亏损 截至本招股说明书签署日,公司核心产品尚处于临床阶段,尚未取得生产批 件亦未实现商业化生产。公司尚未盈利且存在累计未弥补亏损,截至 2020 年末, 公司累计未分配利润为-38,836.32 万元。2018 年度、2019 年度及 2020 年度及 2021 年 1-6 月,公司归属于母公司普通股股东的净利润分别为-3,857.87 万元、 -11,170.46 万元、-48,984.95 万元及-14,808.36 万元,扣除非经常性损益后归属于 母公司普通股东的净利润分别为-5,219.83 万元、-12,526.98 万元、-45,592.38 万 元及-16,205.46 万元。由于未来一段时间内,公司预计仍将增加研发投入,未来 预计仍将存在累计未弥补亏损。
(二)公司仍需持续较大规模的投入在研管线的研发 报告期内,公司投入大量资金用于产品管线的临床前研究、临床试验及上市 申请。2018 年度、2019 年度、2020 年度及 2021 年 1-6 月,公司研发费用分别为 4,893.45 万元、11,609.50 万元、42,893.17 万元及 12,800.68 万元。截至本招股说明书签署日,公司产品管线拥有 10 个主要在研药品项目,同时储备多项处于早 期研究阶段的在研项目。公司未来仍将投入大量研发支出用于推进公司在研产品 完成临床前研究、临床试验及上市申请。根据公司会计政策,公司相关在研药品 的研发支出在未取得生产批准之前均予以费用化,公司的研发费用资本化会计政 策将进一步加剧公司未来亏损,在可预见的未来将导致大量经营亏损产生。
(三)公司无法确保核心产品通过临床 III 期试验并取得上市批准,其上市存在 不确定性 由于临床试验和新药审评审批存在较大的不确定性,公司无法确保核心产品 通过临床 III 期试验并取得上市批准。如公司的核心产品无法通过临床 III 期试验 并取得上市批准,或该等批准为有条件批准且存在重大限制,或公司核心产品获 批时间相较公司预期存在一定延迟,则将对公司的业务经营造成重大不利影响。 公司核心产品能否于预期时间内顺利完成临床 III 期试验并获得监管机构批准上 市亦存在不确定性。
(四)公司无法保证未来几年内实现盈利,公司上市后亦可能面临退市风险 公司产品管线拥有 10 个主要在研药品项目,同时储备多项处于早期研究阶 段的在研项目。公司未来仍将投入大量研发支出用于推进公司在研产品完成临床 前研究、临床试验及上市申请。在公司核心产品上市前,未来经营亏损将不断增 加,公司核心产品上市后预计未盈利状态仍将在一段时间内存续并可能继续扩 大。 截至本招股说明书签署日,公司仅有一款在研产品 HC-1119 处于临床 III 期 阶段,一款在研产品 HP501 已完成临床 II 期试验,尚未开展临床 III 期试验。同 时考虑到公司核心产品 HC-1119 系恩扎卢胺的氘代药物,而恩扎卢胺的仿制药 已于 2021 年 8 月底于中国境内获批上市。虽然恩扎卢胺仿制药获批的适应症与 HC-1119 与中国境内开展 III 期临床的适应症并不相同,但恩扎卢胺及其仿制药 仍可能与公司产品展开竞争。如公司的核心产品无法通过临床 III 期并取得上市 批准,或该等批准为有条件批准且存在重大限制,或公司核心产品获批时间相较 公司预期存在一定推迟,或公司核心产品上市后销售不达预期,自上市之日起第 4 个完整会计年度触发《上海证券交易所科创板股票上市规则》第 12.4.2 条的财务状况,即最近一个会计年度经审计的扣除非经常性损益之前或者之后的净利润 为负值且营业收入低于 1 亿元,或者追溯重述后最近一个会计年度扣除非经常性 损益之前或者之后的净利润为负值且营业收入低于 1 亿元,则可能导致公司触发 退市条件。 公司核心产品目前尚处于临床阶段,若无法通过临床试验或未获得药品注册 证书或产品上市后销售情况不理想,并且在其他在研产品临床试验进展不及预期 的情况下,公司可能触发《上海证券交易所科创板股票上市规则》第 12.4.3 条的 规定,即公司的主要产品研发失败或者未能取得药品上市批准,且公司无其他业 务或者产品符合《上海证券交易所科创板股票上市规则》第 2.1.2 条第五项规定 要求,则亦可能导致公司触发退市条件。 根据《科创板上市公司持续监管办法(试行)》,公司触及终止上市标准的, 股票直接终止上市,不再适用暂停上市、恢复上市、重新上市程序。
(五)公司可能在一段时间内难以实现盈亏平衡 公司研发进度较快的产品 HC-1119 的转移性去势抵抗性前列腺癌的末线治 疗已于 2019 年获 NMPA 批准进入临床 III 期试验,预计于 2022 年提交 NDA; 转移性去势抵抗性前列腺癌的一线治疗已于 2019 年获得 FDA 和 NMPA 批准进 入全球多中心的临床 III 期试验,预计于 2023 年提交 NDA;HP501 的单药治疗 高尿酸血症/痛风适应症已于 2020 年进入临床 II 期试验,预计 2021 年启动临床 III 期试验,预计 2023 年提交 NDA。 公司上述两个产品距离获批上市仍有一定时间,且即使公司产品顺利获批上 市,在新药上市之初的一段时间内销量可能不会立刻大量增加,在市场开拓过程 中如公司产品不能较快被市场接受和认可,则可能在一段时间内不能达到预期的 销售规模。由于发行人生产、销售、研发等经营活动投入较高,相关成本、费用 金额较大,发行人盈亏平衡点销售收入金额较高,发行人可能在一段时间内难以 实现盈亏平衡。
二、公司未来可能无法继续研发除现有产品线以外的其他氘代药物的风险
公司拥有自主研发的核心技术平台之一为氘代药物研发平台。氘代技术目前 海创药业股份有限公司 招股说明书 6 已被广泛地应用于药物的研发当中,包括 HC-1119 和 HP530 等小分子候选新药。 但是,氘代技术对生产技术和质量控制技术有较高要求且原料成本相对较高,进 而导致氘代药物生产成本相对较高;氘代药物除非开展新适应症的临床开发,否 则将面临非氘代药专利到期后仿制药的竞争。随着对氘代技术日益受到各方重视 且其专利保护越发严格,部分药企已开始在新药发明专利中包含氘代衍生物的技 术提示或专利中已包含一些氘代药物的相关生物活性数据,研发氘代新药将面临 较大挑战,公司未来存在无法继续研发除现有产品线以外的其他氘代药物的可能 性。若未来氘代药物生产成本进一步上涨、非氘代药物或仿制药竞争加刷公司氘 代药物专利申请难度进一步提升,则会影响公司产品的研发及商业化,进而对公 司的业务、财务状况造成不利影响。
三、公司 PROTAC 靶向蛋白降解平台面临药物研发、上市失败的风险
PROTAC 概念由 Craig Crews 等人于 2001 年提出,在 2015 年后取得突破性 进展后,全球医药行业才逐渐对 PROTAC 药物研发予以重视,PROTAC 技术发 展时间较短。目前,全球研发进展领先的 PROTAC 药物处于临床 II 期试验阶段, 尚无获批上市药物。尽管公司在 PROTAC 技术上已积累了药物发现、优化筛选、 CMC 工艺及试剂开发等经验,但若 PROTAC 技术存在尚未被发现的固有技术缺 陷、技术路线未获监管机构认可、临床试验结果不达预期等情况,可能导致公司 PROTAC 产品管线研发进展不及预期甚至是研发失败的风险。 此外,尽管 PROTAC 药物有其优越性,但全球范围内尚未有 PROTAC 药物 上市,全球范围内 PROTAC 产品管线均具有临床及商业化失败的风险。
四、公司核心产品之一 HC-1119 的 50%项目权益系从四川海思科受让取得,且公司尚未完成第三期付款
HC-1119 系公司自主研发的新药产品,2016 年 HC-1119 项目即将进入临床 试验阶段,需要大量资金支持进行临床试验,海创有限考虑到自身资金情况、融 资能力、四川海思科的资金优势和其在医药行业的经验与渠道优势,于 2016 年 9 月及 10 月分别与四川海思科签署《框架合作协议》和《恩杂鲁胺氘代物专利 实施许可协议》,两份协议约定:海创有限授予四川海思科及其指定的关联公司作为 HC-1119 项目在中国境内唯一的研发、生产及销售主体,授权四川海思科 独占实施许可专利的权利。双方各占项目收益的 50%,以四川海思科向海创药业 支付专利许可费的方式进行项目权益分配。同时四川海思科承担 HC-1119 项目 境内全部临床试验支出。
2016 年 10 月,海创有限与四川海思科之间签署了《关于<专利实施许可协议>的补充协议》,协议约定如果 2023 年 3 月 30 日之前本协 议所涉专利产品未获得上市药品注册批件且 2023 年 3 月 30 日之前,除本协议所 涉专利产品外,中国境内上市竞争产品的竞争企业的数量超过 2 家,则权益分成 比例由海创有限与四川海思科各占税前利润的 50%修改为 40%比 60%。由于至 解除协议(定义见下文)签署日,上述两款条件均未发生,因此《关于<专利实 施许可协议>的补充协议》亦未实际执行。
2020 年 9 月公司与四川海思科签署了《<恩杂鲁胺氘代物专利实施许可协议> 及相关协议之解除协议》(以下简称“解除协议”)。经双方友好协商,四川海思 科将原获授权的 HC-1119 及以其为活性成分的各种药物制剂专利产品及专利方 法(以下合称“HC-1119 专利产品”)的独占实施许可权、因专利产品在中国境 内产生的新的技术成果及其知识产权的共同所有权及其对临床试验、所涉药品申请药品注册证及新药证书、研发权、生产权、销售权、商业化权、商标(通用名) 及其他知识产权等全部权利转让给公司。解除协议约定,此次转让公司应承担的对价总额包括:
1)应支付四川海思科转让对价计人民币 2.6 亿元,分三期支付。 截至 2021 年 6 月 30 日,第一期、第二期款项计人民币 1.1 亿元,已完成支付, 第三期款项计人民币 1.5 亿元,尚未支付;
2)截至协议签署日四川海思科已经发生但尚未支付的 HC-1119 的第三方临床费用。公司结合该笔交易的交易实质 以及公司自身的研发项目资本化政策,将转让对价作为在研产品权益转让费用计 入研发费用。
2021 年 8 月,经公司与四川海思科进一步商业谈判,签署了《恩杂鲁胺氘 代物专利实施许可协议》及相关协议之解除协议>的补充协议(以下简称“《付 款安排调整协议》”),该协议对解除协议约定的应支付给四川海思科的第三期 款项计人民币 1.5 亿元的付款节点予以明确。约定第三期款项的付款节点修订如 下:(1)海创药业于 2021 年 12 月 31 日向四川海思科指定账户支付人民币 5,000 万元;(2)海创药业于 2022 年 6 月 30 日向四川海思科指定账户支付人民币 3,000 海创药业股份有限公司 招股说明书 8 万元;(3)海创药业于 2022 年 12 月 31 日向四川海思科指定账户支付人民币 7,000 万元。 根据《付款安排调整协议》,公司需在 2022 年 12 月 31 日前合计向四川海思 科支付 1.5 亿元人民币,鉴于支付金额相对较高,届时会对公司 2021 年度及 2022 年度的货币资金等报表科目造成影响,进而对公司经营产生一定不利影响。
截至 2021 年 6 月 30 日,公司货币资金余额为 105,939.75 万元,资产负债率 为 19.92%,短期偿债能力良好,但如果未来无法筹措到足够的营运资金,公司 将可能被迫削减或取消在研项目或推迟在研药品研发和商业化进度,将对公司业 务造成不利影响。
五、公司核心产品 HC-1119 的竞争产品恩扎卢胺的仿制药已获批上市,公司面临与恩扎卢胺仿制药发生竞争的风险
根据公开信息查询,2018 年 10 月,上海复星医药(集团)股份有限公司旗 下子公司上海复星星泰医药科技有限公司成功挑战了恩扎卢胺“二芳基乙内酰 脲化合物”发明专利(ZL200680025545.1)。2018 年 10 月 25 日,国家知识产权 局专利复审委员会作出第 37674 号等无效宣告请求决定书(以下简称“无效宣 告 ” ), 宣 告 涉 案 发 明 专 利 “ 二 芳 基 乙 内 酰 脲 化 合 物 ” ( 专 利 号 ZL200680025545.1)的专利(以下简称“恩扎卢胺化合物专利”)权全部无效。
根据现行有效的《中华人民共和国专利法》,如果专利被国家知识产权局宣 布专利无效,在专利权人通过行政诉讼驳回专利局宣告前,恩扎卢胺的原研厂商 无法通过起诉其他仿制药企业来制止恩扎卢胺仿制药的上市销售。 截至 2021 年 8 月 25 日,豪森药业关于恩扎卢胺仿制药的上市申请已获 CDE 批准,成为首家国产恩扎卢胺仿制药获批上市的企业。
截至 2021 年 8 月 31 日,国家药品监督管理局网站公示信息显示,国内已有 3 家公司进行恩扎卢胺软胶囊仿制药申请,公示的试验进程具体如下: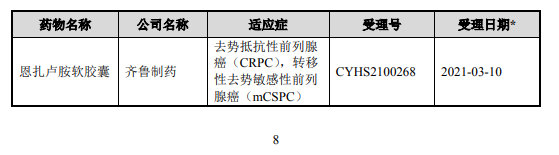
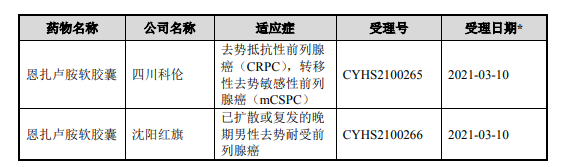
虽然根据国家知识产权局网站查询,HC-1119 的竞争产品恩扎卢胺的化合物 专利在中国将于 2026 年到期,截至本招股书说明书签署日该专利处于专利维持 状态,但已有恩扎卢胺仿制药获批上市。虽然恩扎卢胺仿制药已获批适应症为 ADT 失败后无症状或有轻微症状且未接受化疗的 mCRPC 一线治疗,而 HC-1119 在中国的 III 期临床是针对 mCRPC 末线治疗,HC-1119 与恩扎卢胺及其仿制药 上市销售后在中国境内将形成差异化竞争。但是由于仿制药价格通常显著低于原 研药,该等竞争将仍可能影响公司核心产品 HC-1119 的市场份额及定价策略, 进而可能会对公司的生产经营产生不利影响。
六、公司核心产品 HC-1119 在全球多中心开展Ⅲ期临床试验入组进 展较慢,海外临床试验可能存在延迟或失败的风险
公司于 2019 年经 FDA 批准后在全球开展 mCRPC 未经化疗的一线治疗的多 中心Ⅲ期临床试验,预计在 16 个国家启动共计 80 家中心医院的临床患者招募和 临床试验。截至 2021 年 9 月 2 日,发行人已在全球 5 个国家实现 11 例病人入组。 HC-1119 在全球多中心开展 mCRPC 未经化疗的一线治疗的Ⅲ期临床试验病人入 组较慢主要系疫情反复,导致相关部门和机构在资料审核、病人入院及药品分发 等环节出现了不同程度的延迟。发行人预计将于 2022 年底完成全部 430 例病人 入组,并于 2023 年底提交 NDA。具体时间进度预期如下:
注:上述时间表为预计时间表,未来可能受试验进度、疫情影响和审核政策变化有所调整。 尽管发行人针对 HC-1119 全球多中心Ⅲ期临床试验已制定了详细的入组计 划,但考虑到疫情的不确定性以及发行人海外临床试验的经验较为欠缺,可能导 致发行人海外临床试验不能如期开展甚至失败,进而对公司的全球化经营造成不 利影响。
七、公司核心产品获批上市后可能无法达到销售预期的风险
公司所处的医药制造业市场竞争激烈,尽管公司核心产品 HC-1119 目前正 在进行 III 期临床试验;HP501 正在进行 II 期临床试验,但公司产品在国内市场 存在与已获批同类药物的竞争,其中与公司核心产品 HC-1119 同靶点、同适应 症的恩扎卢胺已于 2020 年通过谈判进入国家医保目录。 HC-1119 及 HP501 获批上市后将面临已上市产品在前期市场推广、已纳入 医保、医生用药习惯等方面的竞争优势局面,若 HC-1119 及 HP501 没有采取有 效的应对措施,可能导致公司核心产品销售不达预期,进而对公司经营产生不利 影响。
八、公司核心产品面临在进入医保目录前定价水平不合理或进入医保 目录降价幅度较大,导致销售不达预期的风险
目前公司尚未组建营销团队,市场营销能力尚未被市场验证,在研产品商业 化存在不确定性。公司无法保证未来针对拟上市药品的市场策略有效并符合市场 实际需求。如公司上市销售的药品在进入医保前在定价、定位、临床使用时机或 病人选择等市场策略上与临床医生或患者的实际需求存在偏离,策略制定不当或 实施效果未达预期,则将对公司产品的商业化前景造成较大不利影响。 尽管公司核心产品在上市后销售的增长可能会依赖于进入国家医保的速度, 如果核心产品进入国家医保后谈判形成的价格较进入国家医保前的价格相比降 幅较大,或对医保报销比例进行限制,或后续被调出医保目录则可能造成核心产 品销售收入不达预期,进而影响公司的盈利能力。
九、公司面临股份支付对业绩产生不利影响的风险
基于公司所处行业属于人才密集型行业的特征,为进一步建立健全公司对员 工的长效激励机制,报告期内公司于 2018 年及 2020 年针对核心人员推出了股权 激励计划。 报告期各期,公司计入期间费用的股份支付费用分别为 187.18 万元、3,342.43 万元、9,161.30 万元及 5,031.97 万元。公司根据会计准则要求进行了股份支付处 理。尽管股权激励有助于稳定人员结构以及留住核心人才,但可能导致较高的股 份支付费用,可能对公司未来经营业绩产生一定程度的不利影响。
(上述内容来源公开资料由小V财讯整理,仅供交流参考使用不作投资建议)








